原子核外电子排布规律目录
原子核外电子排布规律
。
404 Not Found
。
。
。
。
。
。
。
。
核外电子排布规律到底是什么?
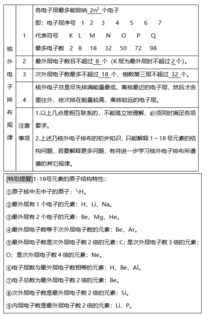
核外电子层排布的规律是2*n^2 n是电子层数 如果是三层 那就是2*9=18 也就是说这第三层排完18个电子才到第四层 但K Ca 不是这样 他们分别是2 8 8 1 ;2 8 8 2
1.原子各电子层最多容纳的电子数是2n2
铌Nb:2,8,18,13
钼MO: 2,8,18,13,1
钯Pd: 2,8,18,18
Uuu:2,8,18,32,32,18,1
Uub:2,8,18,32,32,18,2
Uuq:2,8,18,32,32,18,4
电子在原子核外运动状态是相当复杂的。
一个电子的运动状态取决于它所处的电子层、电子亚层、轨道的空间伸展方向和自旋状况。
科学实验还告诉我们,在一个原子里不可能存在着电子层、电子亚层、轨道的空间伸展方向和自旋状况完全相同的两个电子。
这个原理叫泡利不相容原理。
根据这个原理,可以知道每一个轨道中只能容纳两个自旋相反的电子。
根据这一点,可以推算出每个电子层中最多可容纳的电子数。
2.核外电子的排布规律
核外电子排布遵循泡利不相容原理、能量最低原理和洪特规则。
以上已经提到了泡利不相容原理。
能量最低原理就是在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道。
也就是尽可能使体系能量最低。
洪特规则是在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
后来经量子力学证明,电子这样排布可能使能量最低,所以洪特规则也可以包括在能量最低原理中。
3.元素的金属性和非金属性跟原子结构的关系
从化学的观点来看,金属原子易失电子而变成阳离子,非金属原子易跟电子结合而变成阴离子。
元素的原子得失电子的能力显然跟原子核对外层电子特别是最外层电子的引力有着十分密切的关系。
而原子核对外层电子的吸引力的强弱主要与原子核的核电荷数、原子半径和原子的电子层结构等有关。
高中化学原子核外电子排布
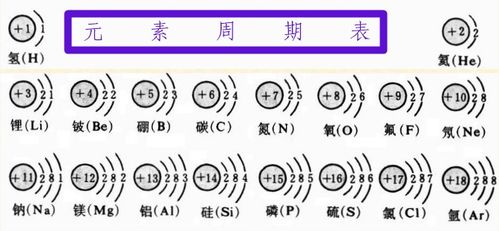
核电荷数61的是钷,电子层排布是2,8,18,23,8,2
亚层有能级交错现象。
各亚层能量由低到高排列如下:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d。
。
。
。
原子外层电子排布规律,急

高二的知识了..你目前应该还不需要了解其中的原理..
电子填入原子轨道(亚层)是按轨道的能量高低,从低到高排的.2881里后面的这个"1"指的是4s轨道中的一个电子,它的能量高于第三层的3p轨道,所以必须先填满第三层的8个电子,才可以往下填.
也许你看不懂,反正也不要了解太深,大致知道是能量高低决定的就差不多了..
4L麻烦看清楚再作评论,我是针对楼主提出的"钾是2881么,为什么不是2872?"回答的,有牵扯到3d吗?请自重,谢谢.
标签:




